Mekanisme kerja enzim dalam
mengkatalisis reaksi kimia adalah dengan berikatan dengan suatu substrat untuk
menghasilkan suatu produk. Ada dua teori yang menjelaskan mengenai mekanisme
tersebut, yakni:
1. Teori Lock
and Key (teori gembok dan kunci)
Teori lock and key menjelaskan bahwa sisi aktif enzim hanya cocok
dengan satu jenis substrat, yang dianalogikan seperti gembok dengan
kuncinya. Enzim diumpamakan sebagai gembok yang mempunyai bagian kecil
yang dapat mengikat substrat (sisi aktif), sedangkan substrat diumpamakan
sebagai anak kuncinya.
 |
| Cara
kerja enzim teori Lock and Key (Sumber: Sembiring & Sudjino, 2009, h. 18) |
2. Teori Induced
Fit (teori ketepatan induksi)
Teori ketepatan induksi menjelaskan bahwa sisi aktif enzim bersifat fleksibel sehingga dapat berubah bentuk menyesuaikan bentuk substrat.
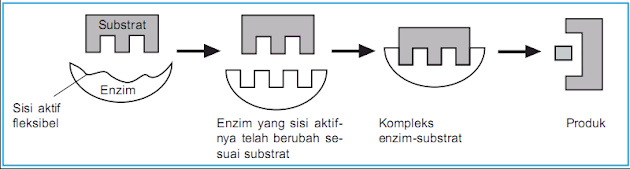 |
| Cara
kerja enzim teori Induced Fit (Sumber: Sembiring & Sudjino, 2009, h. 19) |
Faktor Lingkungan yang Mempengaruhi Kinerja Enzim
Seperti yang telah dijelaskan
dalam sifat enzim sebelumnya, bahwa kinerja enzim juga dipengaruhi oleh faktor-faktor
lingkungan yang akan kita ketahui lebih lanjut sebagai berikut.
1. Suhu
Enzim tersusun dari protein, oleh
karena itu enzim sangat peka terhadap suhu. Suhu yang terlalu tinggi dapat
menyebabkan denaturasi protein (yang berarti enzim telah rusak), dan suhu yang
terlalu rendah dapat menghambat laju reaksi (enzim pada suhu 0°C tidak aktif,
akan tetapi juga tidak rusak). Setiap enzim mempunyai suhu optimum yang
spesifik, jika enzim berada di bawah/di atas suhu optimum maka kerja enzim akan
terhambat. Suhu optimum untuk aktivitas enzim pada manusia dan hewan berdarah
panas ± 37°C, sedangkan pada hewan berdarah dingin ± 25°C.
 |
| Pengaruh
suhu terhadap aktivitas enzim (Sumber: Campbell, et al., 2010, h. 167) |
2. pH (Derajat Keasaman)
Enzim mempunyai pH optimum yang dapat bersifat asam maupun basa. Sebagian besar enzim pada manusia mempunyai pH optimum antara 6–8, misalnya enzim tripsin yang mendegradasi protein. Namun, ada beberapa enzim yang aktif pada kondisi asam, misalnya enzim pepsin.
Perubahan pH dapat mengakibatkan sisi aktif enzim berubah, sehingga dapat menghalangi terikatnya substrat pada sisi aktif enzim. Selain itu, perubahan pH dapat menyebabkan terjadinya proses denaturasi, sehingga menurunkan aktivitas enzim.
 |
| Pengaruh
pH terhadap aktivitas enzim (Sumber: Campbell, et al., 2010, h. 167) |
3. Konsentrasi Enzim dan Substrat
Agar reaksi berjalan optimum,
perbandingan jumlah antara enzim dan substrat harus sesuai. Jika enzim terlalu
sedikit dan substrat terlalu banyak, reaksi akan berjalan lambat dan bahkan ada
substrat yang tidak terkatalisasi. Namun bila semakin banyak penambahan enzim,
maka reaksi akan berjalan semakin cepat hingga dicapai kecepatan konstan.
Kecepatan konstan tercapai apabila semua substrat sudah terikat oleh enzim.
 |
| Hubungan
antara konsentrasi enzim dengan kecepatan reaksi (Sumber: Mader, 1998; Sembiring & Sudjino, 2009, h. 23) |
4. Zat-Zat Penggiat (Aktivator)
Terdapat zat kimia tertentu yang dapat meningkatkan aktivitas enzim. Misalnya, garam-garam dari logam alkali dalam kondisi encer (2%–5%) dapat memacu kerja enzim. Demikian pula dengan ion logam Co, Mg, Ni, Mn, dan Cl. Akan tetapi, mekanisme kerja zat penggiat ini belum diketahui secara pasti.
5. Zat-Zat Penghambat (Inhibitor)
Ada dua macam inhibitor enzim,
yaitu inhibitor reversibel (dapat
kembali) yang tidak berikatan kuat dengan enzim sehingga dapat lepas,
dan inhibitor irreversibel (tidak
dapat kembali) yang berikatan kuat dengan enzim sehingga tidak dapat lepas.
a. Inhibitor Reversibel
Inhibitor reversibel meliputi tiga jenis hambatan berikut.
1) Inhibitor
kompetitif (hambatan bersaing)
Pada
penghambatan ini zat-zat penghambat mempunyai struktur mirip dengan struktur
substrat. Dengan demikian, zat penghambat dengan substrat saling berebut
(bersaing) untuk bergabung dengan sisi aktif enzim.
 |
| Inhibitor
kompetitif (Sumber: Sembiring & Sudjino, 2009, h. 20) |
2) Inhibitor nonkompetitif (hambatan
tidak bersaing)
Penghambatan
ini dipicu oleh terikatnya zat penghambat pada sisi alosterik sehingga sisi
aktif enzim berubah. Akibatnya, substrat tidak dapat berikatan dengan enzim
untuk membentuk kompleks enzim-substrat.
 |
| Inhibitor
nonkompetitif (Sumber: Sembiring & Sudjino, 2009, h. 20) |
3) Inhibitor
umpan balik
Hasil akhir
(produk) suatu reaksi dapat menghambat bekerjanya enzim. Akibatnya, reaksi
kimia akan berjalan lambat. Apabila produk disingkirkan, reaksi akan berjalan
lagi. Inhibisi umpan balik mencegah sel menyintesis lebih banyak produk
dari yang dibutuhkan. Berikut contoh Inhibisi umpan balik.
 |
| Inhibisi
umpan balik pada sintesis isoleusin (Sumber: Campbell, et al., 2010, h. 171) |
b. Inhibitor Tidak Reversibel
Hambatan ini terjadi karena inhibitor bereaksi tidak reversibel dengan bagian tertentu pada enzim sehingga mengakibatkan bentuk enzim berubah. Perubahan bentuk enzim ini mengakibatkan berkurangnya aktivitas katalitik enzim tersebut. Hambatan tidak reversibel umumnya disebabkan oleh terjadinya proses destruksi (perusakan) atau modifikasi sebuah gugus enzim atau lebih yang terdapat pada molekul enzim.
Contoh-contoh enzim dalam proses metabolisme sebagai berikut. Lihat di sini


0 Komentar